先端ナノ・バイオ科学専攻 Major of Advanced Nanociences and Biosciences
Development of organic reactions for natural product syntheses
 薬品製造学 Synthetic & Medicinal Chemistry
薬品製造学 Synthetic & Medicinal Chemistry阿部 仁 Hitoshi Abe
- TEL : 076-445-6851
- URL : http://www3.u-toyama.ac.jp/abe/
- Keywords : Natural product, Organic synthesis, Asymmetric reaction
研究の背景と目的 Background and Purpose of Study
植物や微生物などの天然資源が産生する有機物の中には、優れた機能を持つものが少なくない。しかし一般に、それらの化合物は含有量が少なく、単離精製も困難である場合が多い。化学合成(chemical synthesis)により有用な化合物を大量供給できれば、医農薬の開発や生命活動の仕組みの解明に大きな進歩をもたらすことができる可能性がある。 本研究分野では、複雑な構造を持つ天然有機分子(natural organic molecules)を効率的に化学合成するために必要な分子変換反応(molecular transformation)の開発と、それを用いた生物活性化合物(bioactive compounds)ならびにその誘導体の合成を行なう。
Naturally occurring organic chemical compounds (natural products) often exhibit interesting biological activities. However, amount of such materials supplied from natural sources, involving plants and micro-organisms, is usually insufficient. It is important for the development of pharmaceutical science and other fields to synthesize the natural products by chemical synthesis. We focus on the synthesis of natural organic molecules having unique biological activity by use of novel approaches involving enantioselective reactions, organometallic reagents, enzymatic reactions, and other techniques. Structure-activity relationship is also of particular interest.
本研究の領域横断性
本研究は最先端技術を駆使した有機合成化学が中心となり、標的分子は伝統薬物から最新天然物化学に至るまでの幅広い領域から得られる情報を基に設定される。 天然有機分子はしばしば興味深い生物活性を示すことから、その全合成は重要である。これにより供給された天然物はさらに詳細な生物活性試験に供することが可能となるだけではなく、数々の誘導体の創製にも直結する。従って本研究は、理工学と薬学および周辺領域を横断する課題であり、関連分野間の連携が鍵となる。
研究内容
芳香環同士が直接結合している、「ビアリール型分子」は天然にも数多く見られる重要な部分構造である。このようなビアリール型構造を構築するための手法は Suzuki-Miyaura カップリングや Stille カップリングなどの有力な変換法がいくつか知られている1)。これらの反応は極めて汎用性の高い優れたものであるが、一般にはハロゲン化アリールのほかにアリールボロン酸やアリールスタナンを前もって合成しておくなど、結合すべき芳香環の両方に官能基化を行なう必要がある。 最近、二つの芳香環をエステルまたはアミドで連結すれば Scheme 1 に示すような分子内ビアリールカップリング反応が効率よく進行することが見い出されている2)。この反応では片側の芳香環上に官能基を予め導入しておく必要がないという大きな利点がある3)。
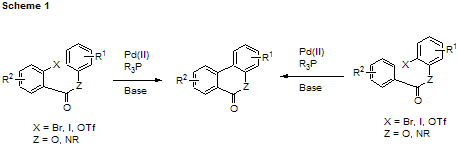
1)Benzo[c]phenanthridine 型アルカロイド、zanthoxyline の合成
Benzo[c]phenanthridine アルカロイドの中には強い生物活性を示すものが数多く知られており、興味深い化合物群である。この化合物群は、芳香環上の置換様式により nitidine 型や chelerythrine 型などに分類されるが、1997年に単離・構造決定された zanthoxyline は、これらとは異なる新しい置換パターンを持つ特異な化合物である。我々は、この新規アルカロイドの生物活性や生合成経路に興味を抱き合成を試みた4)。 対応するカルボン酸とアミンから閉環前駆体1を調製し、パラジウムによるビアリールカップリングを行なった。得られた2を3に変換したが、合成した3のスペクトルデータは報告されているものとは一致なかった(Scheme 2)。

その後、3の類縁化合物を数種合成し、スペクトルデータを比較したところ、zanthoxyline の真の構造を明らかとすることができた。
2)動的速度論的光学分割による軸不斉ビフェニルの合成
フェニルベンゾエート誘導体のビアリールカプリング反応により得られるラクトン体は、適当なキラル求核剤との反応で立体選択的に開環することが報告されている。これは、ラクトンが溶液中で速いラセミ平衡状態にあり、求核剤により速度論的分割が起こっているものと理解されている。 この現象を利用して、(-)-stganone や isorugosin B のメチル化誘導体などの、軸不斉を有するビフェニル型天然物および、関連化合物の合成を行なった (Scheme 3) 5)。

3)Graphislactone 類の合成
モジゴケなどに含まれる graphislactone 類(Figure)の中にも、生物活性を示すものが多い。これらは一様に、分子中にビアリール部位を含む三環性構造を有しており、分子内ビアリールカップリング反応を適用することで容易に合成できる6)。

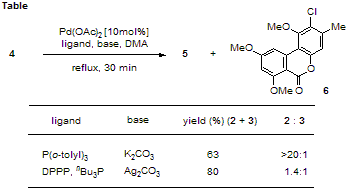 すなわち、対応するフェノール誘導体と安息香酸誘導体を調製後、両者をエステル化にて連結し最後にカップリングを行なうという、極めて単純な経路で合成が可能である。一例として、Scheme 4 に graphislactone G の合成の概略を示した。 この合成において、閉環前駆体4からの Pd 試薬による分子内カップリングでは、望む生成物5の他に位置異性体6が生じた。5と6の生成比は反応条件によって大きく変化した(Table)。
この結果を基に、反応機構の詳細について考察を行なう予定である。
すなわち、対応するフェノール誘導体と安息香酸誘導体を調製後、両者をエステル化にて連結し最後にカップリングを行なうという、極めて単純な経路で合成が可能である。一例として、Scheme 4 に graphislactone G の合成の概略を示した。 この合成において、閉環前駆体4からの Pd 試薬による分子内カップリングでは、望む生成物5の他に位置異性体6が生じた。5と6の生成比は反応条件によって大きく変化した(Table)。
この結果を基に、反応機構の詳細について考察を行なう予定である。
参考文献
- (a) Miyaura, N.; Yanagi, T.; Suzuki, A. Synth. Commun. 1981, 11, 513; (b) Stille, J. Angew. Chem., Int. Ed. 1986, 25, 508; (c) Campeau, L.-C.; Stuart, D. R.; Fagnou, K. Aldrichimica Acta 2007, 40, 35; (d) Hassan, J.; Sevignon, M.; Gozzi, C.; Schulz, E.; Lemaire, M. Chem. Rev. 2002, 102, 1359.
- (a) Hosoya, T.; Takashiro, E.; Matsumoto, T.; Suzuki, K. J. Am. Chem. Soc. 1994, 116, 1004; (b) Ames, D. E.; Opalko, A. Tetrahedron 1984, 40, 1919.
- Abe, H.; Harayama, T. Heterocycles 2008, 75, 1305.
- Abe, H.; Kobayashi, N.; Takeuchi, Y.; Harayama, T. Heterocycles 2010, 80, 873.
- (a) Abe H.; Sahara Y.; Matsuzaki Y.; Takeuchi Y.; Harayama T. Tetrahedron Lett. 2008, 49, 605; (b) Shioe, K.; Takeuchi, Y.; Harayama, T.; Abe, H. Chem. Pharm. Bull. 2010, 58, 435; (c) Takeda, S.; Abe, H.; Takeuchi, Y.; Harayama, T. Tetrahedron 2007, 63, 396.
- (a) Abe, H.; Nishioka, K.; Takeda, S.; Arai, M.; Takeuchi, Y.; Harayama, T. Tetrahedron Lett. 2005, 46, 3197; (b) Abe, H.; Fukumoto, T.; Horino, Y.; Harayama, T.; Takeuchi, Y. Heterocycles, in press.

