認知・情動脳科学専攻 Major of Cognitive and Emotional Neuroscience
Regeneration of neural tissues based on the research of neuro-vascular interaction
 分子神経病態学 Molecular Neuropathology
分子神経病態学 Molecular Neuropathology山本 誠士 Seiji Yamamoto
- TEL : 076-415-8879
- URL : http://www.med.u-toyama.ac.jp/pathol2/index.html
- Keywords : Neuro-vascular interaction, Perivascular cells, PDGF, VEGF, EV.
研究の背景と目的 Background and Purpose of Study
人体再生は人類共通の夢である。これまでに、どのような細胞にも分化するポテンシャルをもつES細胞やiPS細胞が発見され、臓器や組織の再生研究が行われてきた。このような努力によって、幹細胞生物学領域の理解が深まり、幹細胞シグナル研究、創薬科学研究、オルガノイド研究などがここ10年余りで大きく前進した。しかしながら、臓器や組織の再生には至っておらず、人体再生は道半ばである。
成体には組織幹細胞が存在し、緩やかな細胞のターンオーバーを担っていると考えられている。中枢神経系では、成体でも神経幹細胞の存在が認められ、神経組織の傷害などの刺激により活性化するといわれている。神経幹細胞は、脳血管とのインタラクションにより幹細胞としての性質を維持していると考えられている。そのため、血管が提供している神経幹細胞のためのニッチの分子シグナルの解明が重要である。この分子シグナルを解明し、適正にコントロールすることができれば、神経系組織再生の有望な医療シーズになるものと考えられる。
我々は血管系におけるPDGFシグナルやVEGFシグナルにフォーカスし、神経幹細胞とのインタラクション分子の解明や血管周囲に存在する細胞群の神経再生における役割を解明し、神経系組織の再生医療を見据えた研究を展開している。
Regeneration of human body is a dream for all human beings. So far, ES cells and iPS cells, which have a pluripotency, have been discovered, and organ and tissue regeneration utilizing such cells has been done. Through these efforts, we have made great progress in our knowledge in the research area of stem cell biology. However, organ and tissue regeneration have not satisfied.
Tissue stem cells are present in the adult tissues and are thought to be responsible for the turnover of cells that constitute adult tissues. In the central nervous system, the presence of neural stem cells is recognized even in adult central nervous system, and it has been considered that they are activated by stimulation with injury of neural tissues. Since neural stem cells are considered to maintain their potencies through interaction with cerebral blood vessels, it is important to elucidate the molecular signals in the niche for neural stem cells provided by blood vessels. If these molecular signals can be appropriately modulated, it is considered that the signals will be seeds for the regenerative medicine for neural tissues.
By focus on PDGF and VEGF signals in blood vessels, we will elucidate the molecules that are involved in the reciprocal signals between blood vessels and neural stem cells, and will also reveal the role of perivascular cells in regenerative medicine.
本研究の領域横断性
血管と神経のインタラクション研究は、血管と末梢神経が並走しているという解剖学的事実をベースとし、近年の分子生物学的アプローチにより発展した研究領域である。本研究領域は、血管内皮細胞と神経細胞という狭義のインタラクション研究にとどまらず、血管内皮細胞と血管周囲細胞研究や血管が産生するアンジオクライン研究へと発展しつつある。このような研究の可塑性により、細胞間インタラクション研究から臓器間インタラクション研究へと発展しうるものであり、それら研究結果から、人体の発生学的および病態生理学的理解が深化し、新規創薬分子ターゲットを発見し、新たな創薬シーズを創出することに結び付くと考えられる。
The research for neurovascular interaction is considered to a research area developed by the anatomical fact that blood vessels and peripheral nerves run in parallel, and meeting with the approach of molecular biology. This has been developing not only the research of interaction between vascular endothelial cells and neural cells, but also the research of interaction between vascular endothelial cells and perivascular cells, and also research for angiocrine factors produced by blood vessels. The plasticity of such studies allows us to develop from cell-cell interaction studies to organ-organ interaction studies, and the results of these studies deepen our understanding of the developmental and pathophysiological perspectives of the human body. Through these studies, it is thought that the findings will lead to the discovery of molecular targets and novel seeds for new drugs promoting regenerative medicine.
研究内容
生命の維持に最も重要な組織の一つである中枢神経系の再生を考える場合、神経系の組織幹細胞である神経幹細胞の活性化シグナル研究が重要である(Yamamoto et al., PNAS, 2005)。我々はこれまでに、PDGFRβの神経特異的ノックアウト(N-PRβ-KO)マウスを作出し、脳梗塞後の組織再生過程を詳細に検討した。その結果、Control (Flox)マウスと比較して、N-PRβ-KOマウス脳では、これまでに報告のない極めて旺盛な神経前駆細胞の増殖と遊走が観察された(図1)。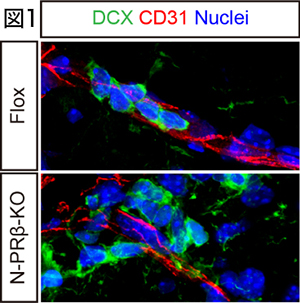 この極めて旺盛な神経前駆細胞の遊走の分子メカニズムとして、N-PRβ-KOマウスの神経前駆細胞ではintegrin α3の過剰発現が観察され、血管に発現しているcollagen type IVをガイドとして梗塞巣へ遊走することを発見した。また、梗塞巣付近の活性化アストロサイトがCXCL12を過剰発現しており、CXCR4陽性神経前駆細胞を梗塞巣付近へ誘導することが明らかとなった(Sato et al., Stem Cells, 2016)。
この極めて旺盛な神経前駆細胞の遊走の分子メカニズムとして、N-PRβ-KOマウスの神経前駆細胞ではintegrin α3の過剰発現が観察され、血管に発現しているcollagen type IVをガイドとして梗塞巣へ遊走することを発見した。また、梗塞巣付近の活性化アストロサイトがCXCL12を過剰発現しており、CXCR4陽性神経前駆細胞を梗塞巣付近へ誘導することが明らかとなった(Sato et al., Stem Cells, 2016)。
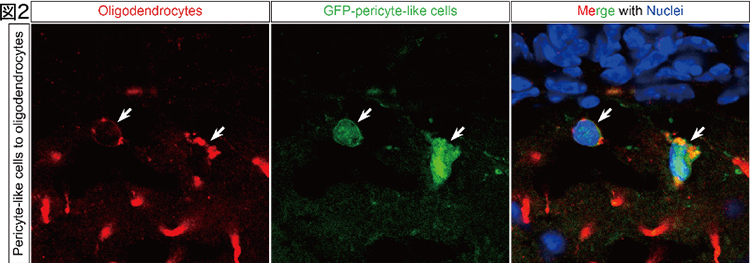
タモキシフェン依存的全身性PDGFRαノックアウト(E-PRα-KO)マウスでは、神経の髄鞘形成に関与するオリゴデンドロサイト前駆細胞(OPC)が速やかに脳の全領域から消失し、3週間で再生することを見出した。これら再生OPCは神経幹細胞とは別の脳血管や髄膜に存在するnestin (幹細胞マーカーの一種)を一時的に発現するペリサイト様細胞由来であることを発見した(図2) (Dang et al., Cell Rep, 2019)。中枢神経系は再生しない組織であるという従来の定説を覆し、想像をはるかに超えた神経系細胞の再生能力を組織幹細胞が有することが示唆される。
血管周囲に存在するペリサイトの研究では、ペリサイトの細胞ソースが少なくとも2種類存在することを解明した。神経堤細胞を効率よく標識することができるPRa-MCマウスを用いて、fate mapping解析を行った結果、神経堤由来細胞はペリサイトと血管内皮細胞に分化することが明らかとなった。また、卵黄嚢由来マクロファージを用いたin vitro, ex vivo解析およびCsf1op/opマウスを用いたin vivo解析の結果、神経発生期において成熟マクロファージが、微小血管に付着した後に分化転換を行い、ペリサイトとして血管成熟に寄与することを解明した(Yamamoto et al., Sci Rep, 2017)。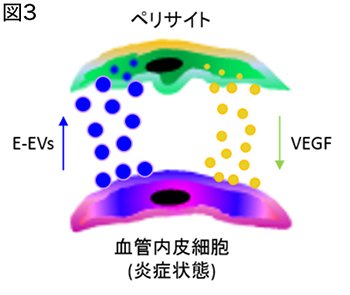 また、ペリサイトと血管内皮細胞はextracellular vesicle (EV)によって細胞間のシグナル伝達を行い、EVに包含される分子シグナルの本質がmicro RNAであることを明らかにした(図3)(Yamamoto et al., Sci Rep, 2015)。
また、ペリサイトと血管内皮細胞はextracellular vesicle (EV)によって細胞間のシグナル伝達を行い、EVに包含される分子シグナルの本質がmicro RNAであることを明らかにした(図3)(Yamamoto et al., Sci Rep, 2015)。
上述のように、血管と神経幹細胞とのインタラクション分子の解明や血管周囲に存在する細胞群の神経再生における役割などの解明に取り組み、神経系組織の再生医療を見据えた研究を展開している。
参考文献
- *, corresponding author
- Hamashima T, Ishii Y, Nguyen QL, Okuno N, Sang Y, Matsushima T, Kurashige Y, Takebayashi H, Mori H, Fujimori T, Yamamoto S*, Sasahara M: Oligodendrogenesis and myelin formation in the forebrain require platelet-derived growth factor receptor-alpha. Neuroscience 436, 11-26, 2020.
- Dang TC, Ishii Y, Nguyen VD, Yamamoto S*, Hamashima T, Noriko O, Nguyen QL, Sang Y, Ohkawa N, Saitoh Y, Shehata M, Takakura N, Fujimori T, Inokuchi K, Mori H, Andrae J, Betsholtz C, Sasahara M: Powerful homeostatic control of oligodendroglial lineage by PDGFRα in adult brain. Cell Rep 27, 1073-1089, 2019.
- Yamada K, Hamashima T, Ishii Y, Yamamoto S*, Okuno N, Yoshida Y, Yamada M, Huang TT, Shioda N, Tomihara K, Fujimori T, Mori H, Fukunaga K, Noguchi M, Sasahara M: Different PDGF receptor dimers drive distinct migration modes of the mouse skin fibroblast. Cell Physiol Biochem 51, 1461-1479, 2018.
- Kitahara H, Kajikawa S, Ishii Y, Yamamoto S*, Hamashima T, Azuma E, Sato H, Matsushima T, Shibuya M, Shimada Y, Sasahara M: The novel pathogenesis mediated by multiple RTK signals is uncovered in newly developed retinopathy mouse model. EBioMedicine 31, 190-201, 2018.
- Yamamoto S*, Muramatsu M, Azuma E, Ikutani M, Nagai Y, Sagara H, Koo B-N, Kita S, O'Donnell E, Osawa T, Takahashi H, Takano K, Dohmoto M, Sugimori M, Usui I, Watanabe Y, Hatakeyama N, Iwamoto T, Komuro I, Takatsu K, Tobe K, Niida S, Matsuda N, Shibuya M, Sasahara M: A subset of cerebrovascular pericytes originates from mature macrophages in the very early phase of vascular development in CNS. Sci Rep 7, 3855, 2017.
- Sato H, Ishii Y, Yamamoto S*, Azuma E, Takahashi Y, Hamashima T, Umezawa A, Mori H, Kuroda S, Endo S, Sasahara M: PDGFR-β plays a key role in the ectopic migration of neuroblasts in cerebral stroke. Stem Cells 34, 685-698, 2016.
- Horikawa S, Ishii Y, Hamashima T, Yamamoto S*, Mori H, Fujimori T, Shen J, Inoue R, Nishizono H, Itoh H, Majima M, Abraham D, Miyawaki T, Sasahara M: PDGFR plays a crucial role in connective tissue remodeling. Sci Rep 5, 17948, 2015.
- Yamamoto S*, Niida S, Azuma E, Yanagibashi T, Muramatsu M, Huang TT, Sagara H, Higaki S, Ikutani M, Nagai Y, Takatsu K, Miyazaki K, Hamashima T, Mori H, Matsuda N, Ishii Y, Sasahara M: Inflammation-induced endothelial cell-derived extracellular vesicles modulate the cellular status of pericytes. Sci Rep 5, 8505, 2015.
- Muramatsu M, Yamamoto S, Osawa T, Shibuya M: Vascular endothelial growth factor receptor-1 signaling promotes mobilization of macrophage lineage cells from bone marrow and stimulates solid tumor growth. Cancer Res 70, 8211-8221, 2010.
- Yamamoto S, Yoshino I, Shimazaki T, Murohashi M, Lax I, Okano H, Shibuya M, Schlessinger J, Gotoh N: Essential role of Shp2-binding sites on FRS2alpha for corticogenesis and for FGF2-dependent proliferation of neural progenitor cells. Proc Natl Acad Sci USA 102, 15983-15988, 2005.

