先端ナノ・バイオ科学専攻 Major of Advanced Nanociences and Biosciences
Folding assistance of glycoprotein by ER-resident molecular chaperone.
 ナノバイオ分子設計学 Nano-Biomolecular Design Chemistry
ナノバイオ分子設計学 Nano-Biomolecular Design Chemistry迫野 昌文 Masafumi Sakono
- TEL : 076-445-6845
- URL : http://www3.u-toyama.ac.jp/biochem/
- Keywords : Molecular chaperone, Protein folding, Protein disulfide isomerase, Protein-protein interaction
研究の背景と目的 Background and Purpose of Study
タンパク質は生体内における様々な化学反応の中心的役割を果たしている。タンパク質が正しく機能を示すには、高次構造形成(フォールディング)が重要な意味を持つ。小胞体(ER)において作製される糖タンパク質のフォールディングは、糖鎖構造を認識する様々なレクチンタンパク質とフォールディング形成補助を行う分子シャペロンが協同的に働いている。中でも、小胞体のカルネキシン(CNX)カルレティキュリン(CRT)サイクルは、糖タンパク質の品質管理に重要な役割を果たす。高マンノース型糖鎖を有する初期糖タンパク質は、分子シャペロン、糖転移酵素、糖加水分解酵素などの様々なタンパク質の仲介により、成熟した状態となる。糖加水分解酵素によりグライコフォームをGlc3Man9GlcNAc2(G3M9)からG1M9にトリミングされた糖タンパク質は、レクチンシャペロンCNX/CRTの基質となる。CNX/CRTから解離した糖タンパク質は、glucosidaseIIによるGlcのトリミングを受ける。正常にフォールディングした糖タンパク質はゴルジ体へ輸送されるが、フォールディングが不完全な糖タンパク質は、UGGTによりグルコースの転移を受け再びCNX/CRTの基質となる。しかし、共同的なフォールディング補助において、それらの補助因子がどのようなネットワークを築いているか不明な点が多い。本研究では、糖タンパク質作製における小胞体内タンパク質社会を明らかにすることを目的とする。
Glycan processing plays an important role in glycoprotein quality control in the endoplasmic reticulum (ER). As nascent glycoproteins bearing triglucosylated high-mannose-type N-glycan (Glc3Man9GlcNAc2; G3M9) are generally unfolded, various carbohydrate active proteins and chaperones in the ER assist them in achieving mature folding. Namely, in the beginning, nascent glycoproteins are trimmed by glucosidase-I and -II to the Glc1Man9GlcNAc2 (G1M9) glycoform and then captured by ER-residing chaperones calnexin (CNX) or calreticulin (CRT). Both CNX and CRT are characterized by their property as lectins, which are specific to monoglucosylated glycans, typically G1M9. In addition, ERp57, a member of the protein disulfide isomerase family, is in association with CNX/CRT, and facilitates disulfide bond formation and isomerization. Subsequently, upon removal of remaining glucose residue by glucosidase II, client glycoproteins are liberated from CNX/CRT. At this stage, their folding states are surveyed by a folding sensor enzyme, UDP-glucose: glycoprotein glucosyltransferase (UGGT). When the folding is incomplete, liberated glycoproteins are reglucosylated by UGGT, regenerating the monoglucosylated glycoforms (e.g. G1M9), which are re-captured by CNX/CRT. After repeated interaction with glucosidase II, CNX/CRT, and UGGT (CNX/CRT cycle), glycoproteins that have achieved mature folding are exported to the Golgi apparatus. The purpose of this study is to reveal network among molecular chaperones assisting glycoprotein preparation.
本研究の領域横断性
小胞体シャペロンは細胞ストレスと関わりが強く、正常なフォールディングが阻害されることで様々な疾患の要因となることがわかっている。糖タンパク質の作製機構を知ることは、タンパク質異常が引き起こす難病の理解につながると期待される。
研究内容
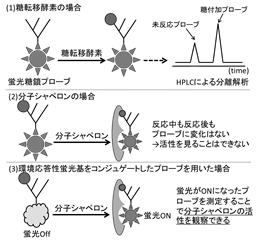
レクチン様分子シャペロンの活性を可視化し、解離定数の測定や、より詳細な生物物理定数の導出を可能にする新規糖鎖プローブの開発を行う。これまでに申請者が用いた糖鎖プローブは、図に示すように糖転移酵素などによりプローブの構造に変化が加えられることで活性を評価してきた。しかし、分子シャペロンは、タンパク質構造の巻き戻りをアシストする性質であるため、糖鎖構造に直接影響を与えず、相互作用した糖鎖プローブには物理的変化が与えられない。形成した分子シャペロン-基質複合体を未反応の基質と分離することで形成割合を測定する方法も考えられる。しかし、通常、分子シャペロンの解離定数はμMオーダーと弱い力であるため、未反応基質との分離中における複合体の解離に伴う誤差が無視できない。したがって、より正確に評価するには、シャペロンと複合化した際に、変化を生じるようにプローブに工夫を施すことが必要となる。そこで、分子シャペロンの基質認識の駆動力である疎水性相互作用を利用し、疎水性雰囲気下で蛍光波長が変化する蛍光基をコンジュゲートした糖鎖プローブを新たに合成する。この新規糖鎖プローブを用いて、シャペロンの活性を、未反応基質の分離操作を行うことなく、その場で観察が可能となる活性評価手法の確立を目指す。
参考文献
Hitomi Nakao, Akira Seko, Yukishige Ito, Masafumi Sakono*: PDI family protein ERp29 recognizes P-domain of molecular chaperone calnexin. Biochemical and Biophysical Research Communications, 487(2017) 763-767.
Masafumi Sakono*, Akira Seko, Yoichi Takeda, Masakazu Hachisu, Akihiko Koizumi, Kohki Fujikawa, Hideharu Seto, Yukishige Ito: Influence of high-mannose glycan whose glucose moiety is substituted with 5-thioglucose on calnexin/calreticulin cycle. RSC Advances, 6 (2016)76879-76882.
Kenta Kitauchi, Masafumi Sakono*: Glycoprotein quality control-related proteins effectively inhibit fibrillation of amyloid beta 1–42. Biochemical and Biophysical Research Communications, 481 (2016) 227-231.
Masafumi Sakono*, Akira Seko, Yoichi Takeda, Yukishige Ito: PDI family protein ERp29 forms 1:1 complex with lectin chaperone calreticulin. Biochemical and Biophysical Research Communications, 452 (2014) 27-31.
Masafumi Sakono, Akira Seko, Yoichi Takeda, Jun-ichi Aikawa, Masakazu Hachisu, Akihiko Koizumi, Kohki Fujikawa, Yukishige Ito: Glycan specificity of a testis-specific lectin chaperone calmegin and effects of hydrophobic interactions. Biochimica et Biophysica Acta (BBA) - General Subjects, 1840 (2014) 2904-2913.

