先端ナノ・バイオ科学専攻 Major of Advanced Nanociences and Biosciences
Development of an optical sensing system for minimally invasive monitoring of vital ions and metabolites
 ナノサイズ機能性分子設計学 Nano-Size Functional Molecule Design Chemistry
ナノサイズ機能性分子設計学 Nano-Size Functional Molecule Design Chemistry遠田 浩司 Koji Tohda
- TEL : 076-445-6864
- URL : http://www3.u-toyama.ac.jp/environ/
- Keywords : in vivo monitoring, minimally invasive sensing, metabolites, optical sensor, telemetry
研究の背景と目的 Background and Purpose of Study
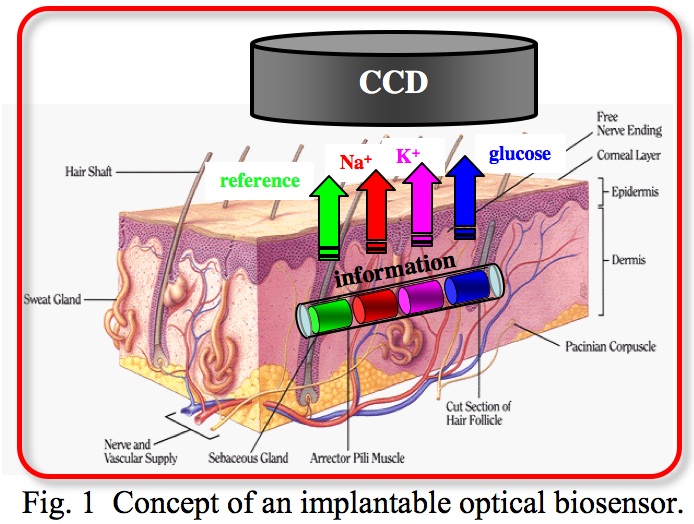
我々は,生体中金属イオン(vital ions)や代謝物(metabolites)を選択的に認識するレセプター分子(receptor molecules)の設計及び合成,レセプター分子認識に伴う光学的情報変換(signal transduction)のための機能性分子(functional molecules)の開発を行い,これらの合成分子を用いたオプティカルバイオセンサー(optical biosensors)の開発研究を行ってきた。これらのセンサーを,体液中の電解質や代謝物を連続的にモニターできる生体内環境分析のための低侵襲皮下埋め込み型センシングシステム(minimally invasive sensing system)へと展開することを目的とし研究を進めている(図1)。
In order to develop reliable optical biosensors, we have designed and synthesized receptor molecules for metabolites such as glucose or lactate and ions such as potassium or sodium in the human body, and functional molecules that convert interactions of the molecular recognition to optical signals. We will conduct the research on the development of a novel optical sensing system based on the synthesized molecules, which would be implanted intradermally and interrogated transdermally using light, for minimally invasive monitoring of vital ions and metabolites as a tool of biochemical and clinical analyses (Fig. 1).
本研究の領域横断性
本研究における生体中の電解質や代謝物を認識し情報変換する比較的低分子量の機能性分子の設計・化学合成とそれらに基づくセンサーの構築は,我々理工学系有機合成・分析化学の領域であるが,開発したセンサーを皮膚直下に埋め込み電解質や代謝物を連続的にモニターするシステムを構築するためには,医学薬学系の領域との共同研究が必須であり,領域横断的な研究が重要となる。
研究内容
1)酵素に基づく色変化応答型糖センサーの開発
現在一般に使用されている自己採血型血糖値測定計は,表面にグルコース酸化酵素を固定化した電極を用い酸化還元電流を測定する電気化学測定に基づくものである。一方,我々はグルコース酸化酵素を用い,電流ではなくセンサー自身の可逆的な色の変化を観ることによってグルコース濃度を測定するオプティカル糖センサーの開発研究をおこなってきた(文献2-6)。このセンサーは図2に示すように,ハイドロゲルフィルムに細孔をあけ,ここにグルコース酸化酵素と機能性色素を坦持したビーズを詰め込み,ハイドロゲル薄膜で覆ったカプセル状のものである。
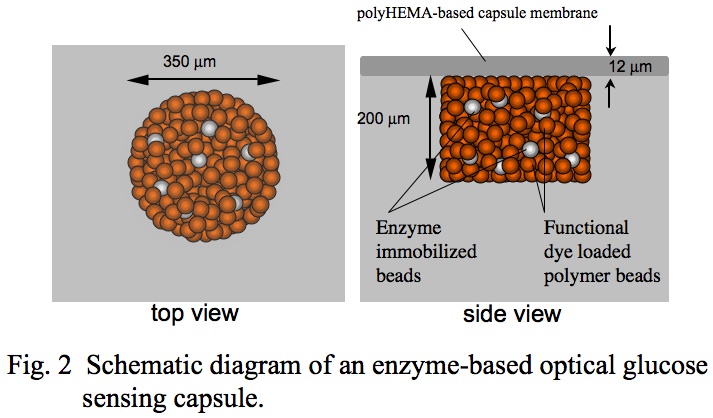
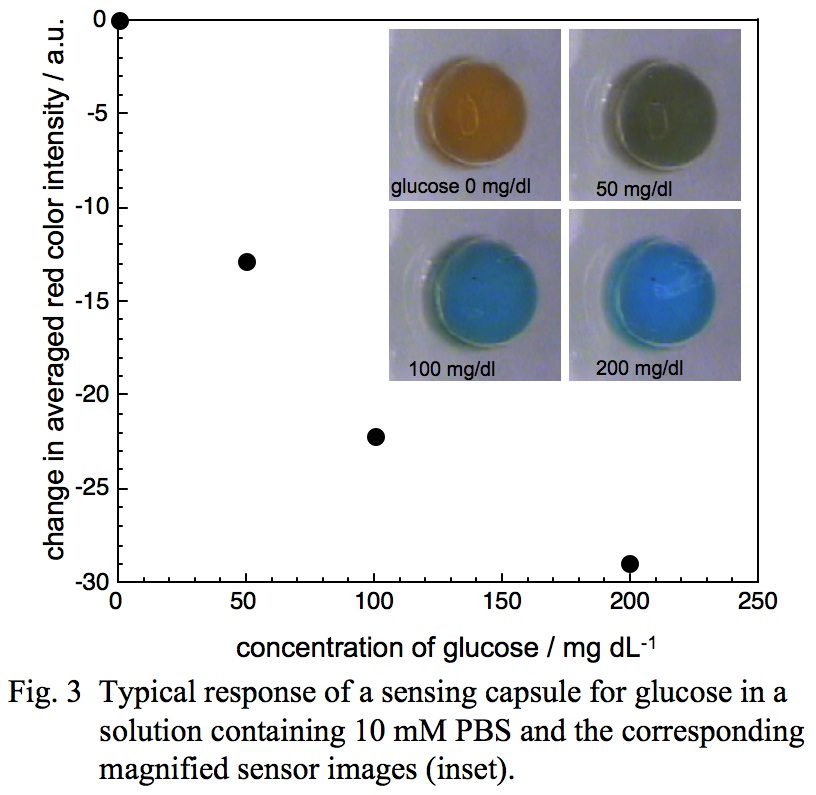
このオプティカルセンサーの応答機構は,カプセル薄膜を横切りカプセル内に拡散した試料中のグルコースが酵素反応により酸化され,生じたグルコン酸とカプセル中の機能性色素が相互作用し,センサーの色が変化するというものである。カプセル薄膜のグルコン酸に対する透過性を制御することによって,カプセル内グルコン酸が濃縮され,これによりグルコースに対する色変化応答シグナルが増幅されるため,生理的グルコース濃度領域でセンサーの色が橙色から鮮青色へと可逆的かつ鮮明に変化し,センサーの色を観るだけでグルコース濃度を知ることができるセンサーとなる(図3)。
2)グルコースに対して高い認識能を有するビスボロン酸レセプターの開発
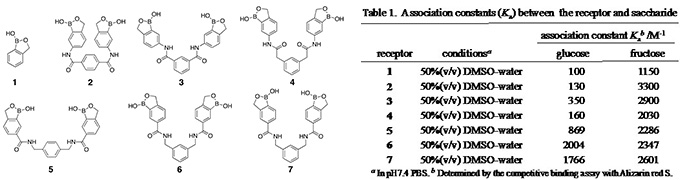
酵素に基づく糖センシングは,酵素の基質特異的触媒作用によって応答シグナルの増幅が可能となるが,酵素の熱的・化学的不安定さのためにセンサー寿命が限られ,皮下埋め込み型とするには適さない可能性がある。そこで我々は,化学合成糖レセプターと機能性色素を組み合せたかたちの新規オプティカル糖センシングフィルムの開発を目指して,化学合成グルコースレセプターの開発研究を行っている(文献6)。 フェニルボロン酸(PBA)は糖レセプターの認識サイトとして広く用いられているがグルコースに対する錯形成能が低いという問題点がある。近年ヒドロキシメチル基をPBAのオルト位に導入(benzoboroxole (BB), 1)することによりグルコースに対する認識能が向上することが報告された。この糖認識能の向上は,グルコピラノース型の4,6-diolを認識しているためと推定される。そこで我々は,グルコースに対して更なる高い認識能を有するレセプターの開発を目指し,同一分子内に2つのBBを有し,グルコースの1,2-及び4,6-diol部位を同時に認識するbis-BBレセプターの設計・合成とその糖認識能の評価を行ってきた。分子内の2つのBBを結合するスペーサーの種類を変えることによって,BB間距離,BBの分子内配向,スペーサーの柔軟性の異なる17種類のbis-BBレセプターを設計・合成し,そのグルコースに対する認識能を評価した結果,m-ジアミノキシレンをスペーサーとするレセプター6が最大のグルコース認識能を有することを見出した(表1)。レセプター6は,これまで報告されているグルコースレセプターの中で最も優れたものの一つである。
3)競争的錯形成反応に基づくオプティカルグルコースセンシングフィルムの開発
我々は更に,開発したグルコースレセプター6に基づくオプティカルグルコースセンサーの構築を試みた。レセプター6に重合性官能基を導入したレセプター8を合成し,単官能モノマー(ジメチルアクリルアミド,DMAA)と共重合することによってレセプター共重合フィルムを得た。このフィルムに重合性官能基を導入したレセプター感受性アゾ色素モノマーとDMAAを含浸させ,再び共重合することによってセミ相互侵入構造(semi-IP)のグルコースセンシングフィルムを構築した。このセンシングフィルムは,レセプター/色素錯体が高分子フィルムの架橋点となっており,レセプターのグルコースとレセプター感受性色素間の競争的錯形成反応により色素が解離し色変化をもたらす。同時に色素の解離は高分子フィルムの架橋点の減少をもたらすので,フィルムは膨潤し,これにより更なる架橋点の解離,すなわちグルコースに対する応答の増幅をもたらす(図4)。
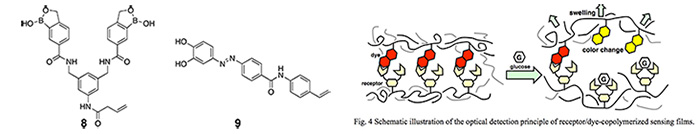
図5に,レセプター8と色素9に基づくsemi-IP構造共重合型センシングフィルムのグルコースに対する吸収スペクトル応答を示す。グルコース濃度の増加に伴い,432 nm付近のピークが消失すると共にフィルムの膨潤に伴って吸光度が全波長領域で減少していることが分かる。
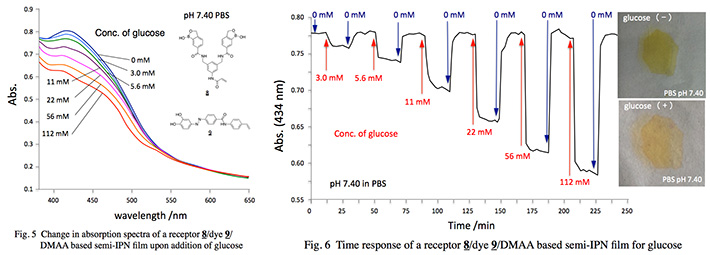
図6にレセプター8と色素9に基づくsemi-IPN構造共重合型センシングフィルムのグルコースに対する吸光度応答の経時変化を示す。グルコース濃度に応じた高分子ポリマーの膨潤・収縮により,2分程度の応答時間で可逆的な吸光度応答を示した。この応答の可逆性は,センシングフィルム構築時の重合性レセプターとレセプター感受性色素の添加量及び微量の架橋剤の存在に大きく依存しており,フィルム中レセプター濃度に対する色素濃度が低い程,応答のダイナミックレンジは減少するものの応答の可逆性は向上することを見出している。
参考文献
- M. Yoshida, K. Tohda, M. Gratzl, Anal. Chem., 75, 4686-4690 (2003).
- M. Yoshida, K. Tohda, M. Gratzl, Anal. Chem., 75, 6133-6340 (2003).
- K. Tohda, M. Gratzl, Chemphyschem, 4, 101-107 (2003).
- K. Tohda. M. Gratzl, Anal. Sci., 22, 383-388 (2006).
- K. Tohda, T, Yamamoto, M. Gratzl, Supramol. Chem. 22, 425-433 (2010).
- K. Tohda, Bunseki Kagaku. 62, 903-914 (2013)

