先端ナノ・バイオ科学専攻 Major of Advanced Nanociences and Biosciences
FBiomaterial Design for Strict Regulation of Cells and Application to Regenerative Medicine
 ナノバイオ分子設計学 Nano-Biomolecular Design Chemistry
ナノバイオ分子設計学 Nano-Biomolecular Design Chemistry中路 正 Tadashi Nakaji-Hirabayashi
- TEL : 076-445-6552
- URL : http://nakaji-lab.net/index.html
- Keywords : Bioactive materials, Bioinactive materials, Chimeric proteins, Stem/progenitor cells, Regenerative bioengineering
研究の背景と目的 Background and Purpose of Study
分子生物学、幹細胞生物学の研究領域は日進月歩であり、様々な知見が集積されている昨今、細胞を用いた医療はますます現実味を帯びている。しかしながら、いくつかの大きな問題、特に、『移植細胞の生着率の低さ』と『移植組織内(挫滅した組織内)での移植細胞の制御不能』を克服できず、臨床応用には至っていないのが現状である。 当研究グループでは、それらの課題を克服できるようなバイオマテリアルの設計を目指している。特に我々は、材料設計においてタンパク質および機能高分子に着目した。タンパク質は、細胞制御を担う主たる要素と言っても過言ではない。そのタンパク質を「必要な時に」「特定の場所で」「必要な量だけ」自在に作用させるシステムを構築できれば、生体内における細胞制御にとって大きな武器になる。 そこで、キメラタンパク質 (融合タンパク質とも呼称される) の生体高分子・合成高分子・固体表面等への担持技術(タンパク質アンカーリング)による、細胞・組織制御能を付与した材料の開発を目指しており、現在、中枢神経疾患治療をターゲットとした、細胞移植治療のためのインジェクタブルゲルの開発を進めている。 バイオマテリアル設計において、生体との親和性を考えなければならないが、前述のような、細胞へ特異的に作用させる材料とは真逆の性質、つまり「不可侵」であり様々な「生体反応を乱さない」イナートな材料創製も不可欠である。これまでに、当研究グループでは、生体物質非応答性を有する双性イオン型高分子や電荷中和型高分子を利用した、タンパク質・細胞のパターニングが可能な表面改質法の開発を進めてきた。現在、生体物質非応答性の付与技術を応用した、骨・軟骨再生のためのバイオセラミック表面改質・新規骨補填材料の開発を進めている。
A creation of biomaterials having an ability to regulate the response to cells and tissues contributes to the further development of not only cell-based therapies but also cell and molecular biology. We have intensively developed bio-active materials which efficiently act to cells and tissues and bio-inactive materials which have an inert property against cells. As the bio-active material, our group has developed a functional hydrogel modified with chimeric proteins, which are fused with cell regulation domain such as growth factors and trophic factors and oligopeptide domain for the specific interaction to substrates. The greatest characteristic of functional hydrogel is that specific cells can be continuously provided the signaling transduction because proteins are anchored to hydrogel through the specific interaction between hydrogel and oligopeptide domain. By using protein-modified hydrogel, the graft survival of neural progenitor cells drastically increased and grafted cells can be strictly regulated the differentiation into dopaminergic neuron. Moreover, we have developed two bio-inactive materials from the view point of charge-neutralization: (1) one is neutralized between polymers by mixing of anion/cation polymers and (2) the other is intermolecularly neutralized using zwitterionic polymers. The surface charges of the both materials are neutral as same as typical neutral polymer materials, whereas they enhanced uniform-construction of the rigid hydroxyapatite layer (enamelum) on the surfaces. It should be noted that the polymer surfaces significantly suppressed protein adsorptions, namely, an interfusion of proteins into HAp layer. These materials are expected to be applied as a bone prosthetic material.
本研究の領域横断性
再生医療の発展に貢献する材料開発では、材料そのものの化学的・物性的評価はもちろんのこと、生物学的評価が必須である。加えて、動物を用いたin vivo評価で得られる結果は、臨床応用のための重要な情報を与えてくれる。それらの情報を、臨床応用という観点からどのように解釈し、材料最適化へフィードバックするのがベストであるかは、医学・薬学分野の研究者の経験と知恵に基づいて考えるべきである。医薬理工の研究者からなる本生命融合科学教育部は、医薬分野の研究者との交流が容易であり、有益なディスカッションを行えることから、バイオマテリアル研究・開発を行う当グループにとって最適な環境であるといえる。
研究内容
研究テーマ1:パーキンソン病治療用移植細胞保護ハイドロゲルの創製
当研究グループでは、5% 未満と言われる移植細胞の生着率を大幅に向上させ、その生着細胞をin situで機能制御することが可能なハイドロゲルの構築を目指している。本材料は、神経細胞接着促進キメラタンパク質 (LGキメラ)、初期炎症を局所で鎮静化させる放出型抗炎症性サイトカインキメラタンパク質 (IL10キメラ)、細胞保護と分化制御を担うキメラタンパク質の担持、そして、タンパク質作用を局所で時空間的に制御し終末分化を効率良く誘導できる二層構造高分子微粒子で構成される (Figure 1)。
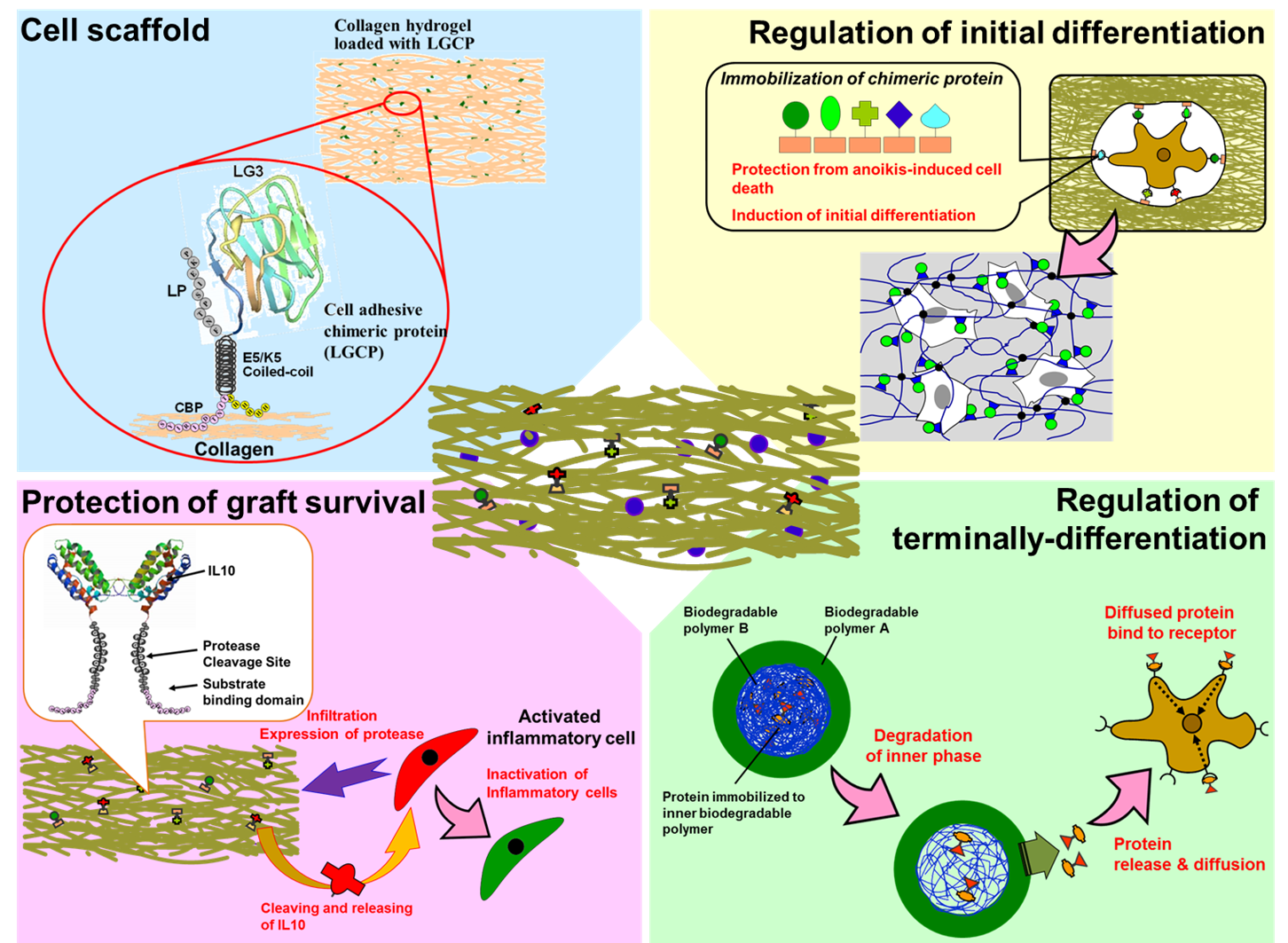 Figure 1. Schematic illustration of hydrogel system for protecting the transplanted cells and for regulating the differentiation of engrafted cells into dopaminergic neurons.
Figure 1. Schematic illustration of hydrogel system for protecting the transplanted cells and for regulating the differentiation of engrafted cells into dopaminergic neurons.
Figure 2に、移植後初期の各移植群の細胞生存率を示す。足場の役割を担うLGキメラタンパク質および炎症の鎮静化を担うIL10キメラタンパク質を担持したハイドロゲルの使用により、初期生着率が飛躍的に向上した (約55%)。この結果は、①移植細胞に足場を提供すること (アノイキス依存細胞死からの回避)と②炎症細胞である活性化ミクログリアの鎮静化および初期炎症の惹起に伴う炎症性サイトカイン産生の抑制に起因するものであることがわかった。 次に、細胞・材料共移植によるパーキンソン病態の改善について評価した (Figure 3)。Figure 3に示す結果は、アポモルフィンローテーションテストと言い、右脳線条体のみ挫滅させたラットへアポモルフィンを投与し、その後の左旋回運動数からパーキンソン病態を評価するものである。アポモルフィン投与後のラットの左旋回運動の減少は、病態改善を意味する。結果を見てみると、細胞と本開発ゲルの共移植群 (Figure 3, Red) の移植後12週において、5回転以下を示した (この約5回転も左右両方に回った結果である)。また、組織学的評価より、移植組織内で、ドーパミン神経網の構築が認められた。これらの結果は、本ハイドロゲルシステムが、移植細胞を生着させ、in situでの選択的な分化を誘導できていることに起因するものであると示唆される。また、この様な劇的な病態改善は他に例が無く、革新的な結果である (論文投稿中)。
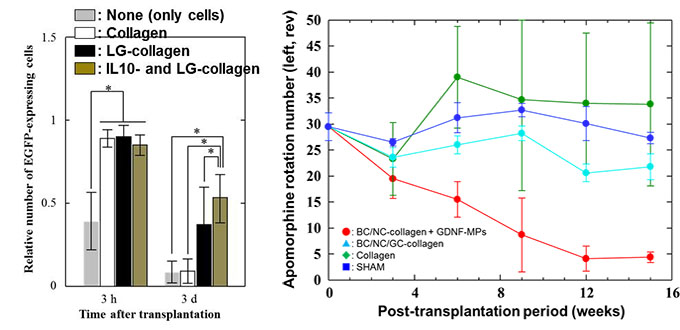
| Figure 2. Initial graft survival of neural progenitor cells transplanted into the striatum with / without hydrogel system. | Figure 3. Apomorphine rotation test of Parkinson’s rats transplanted neural progenitor cells and hydrogel system of (Red) BDNF/NGF/LG- anchored collagen and GDNF-loaded micro particle, (Green) BDNF/NGF/GDNF/LG-anchored collagen, (Light blue) LG-anchored collgen, (Blue) none-hydrogel. |
研究テーマ2:バイオインアクティブ表面改質の骨再生医療への応用
インプラント金属材料を始めとする骨補填材料は、材料と骨がうまく融合せず、補強や再置換等の追加的治療が必要となるため、患者への負担が大きいことが問題となっている。この対策としては、骨の元となるヒドロキシアパタイト (HAp) を剥離しないように材料表面へコーティングさせる技術が必要と考えられている。 そこで当研究グループでは、強固で安定したHApコーティングが可能な材料、または、手法の開発を目指した研究を進めている。こせるという報告があるがれまでに、陰イオンを側鎖に有する高分子によって材料表面を被覆することによって、HAp沈着量を向上さ、Ca2+とPO43- からなるHAp結晶を安定して沈着させるためには、双性イオン型高分子や電荷中和型高分子を利用できるのではないかと考えた (Figure 4)。また、双性イオン型高分子や電荷中和型高分子は、タンパク質吸着を抑制することがすでに知られているが、この特性を活かすことで、タンパク質を取り込まない強固なHAp層 (エナメル質や象牙質) を形成できると予想した。そこで、正負両電荷を有する高分子を骨-材料融合促進材料または表面の開発へ応用することを試みている。
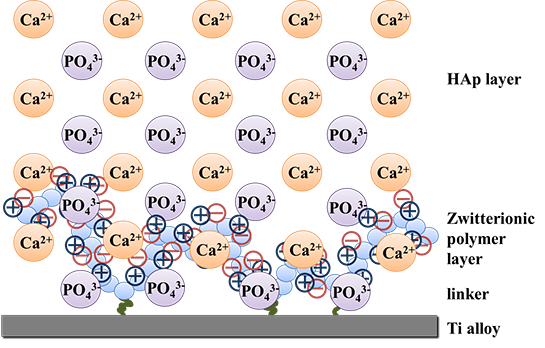 Figure 4. Schematic illustration of HAp crystal structure which fuses with zwitterionic polymer immobilized to the titanium alloy surface.
Figure 4. Schematic illustration of HAp crystal structure which fuses with zwitterionic polymer immobilized to the titanium alloy surface.
Figure 5は、チタン合金にPCMBを被覆した表面上へのHAp沈着を評価した結果であるが、PCMBで被覆された表面には、強固な (超音波処理でも剥離しない) HAp層が形成されていることがわかった。また、電荷中和型ポリマー素材表面でも、強固なHAp層の形成促進が認められた (Figure 6)。これらの結果から、双性イオン型高分子によるバイオセラミック表面被覆や電荷中和型高分子素材の骨補填材料としての応用は、今後の骨再生医療において、有用な一手法になり得ると考えられる。
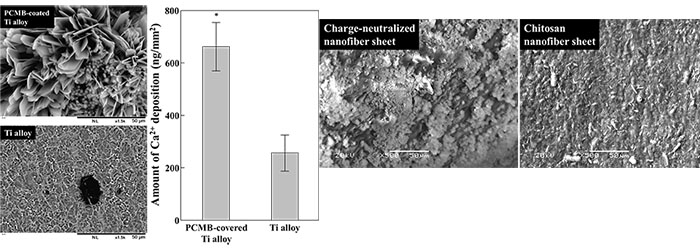
| Figure 5. HAp deposition on the Ti alloy substrate modified with/without PCMB. (Left) Scanning electron microscope images of Ti alloy surface. (Right) amount of Ca2+ deposited on the Ti alloy surface coated with/without PCMB. | Figure 6. Scanning electron microscope images of HAp deposited onto the nanofiber sheets, (Left) charge-neutralized chitosan/carboxymethyl cellulose nanofiber composite sheet, (Right) chitosan nanofiber sheet. |

